

Jebkura vienības garuma saraušanās spēku uz šķidruma virsmas sauc par virsmas spraigumu, un vienība ir N. · M-1.

Šķīdinātāja virsmas spraiguma samazināšanas īpašību sauc par virsmas aktivitāti, un vielu ar šo īpašību sauc par virsmas aktīvu vielu.
Virsmas aktīvā viela, kas var saistīt molekulas ūdens šķīdumā un veidot micellas un citas asociācijas, un tām ir liela virsmas aktivitāte, vienlaikus ar mitrināšanas, emulģēšanas, putošanas, mazgāšanas utt. Ietekmi sauc par virsmaktīvo vielu.
Virsmaktīvā viela ir organiski savienojumi ar īpašu struktūru un īpašību, kas var ievērojami mainīt saskarnes spriedzi starp divām fāzēm vai šķidrumu virsmas spraigumu (parasti ūdeni) ar mitrināšanu, putošanu, emulģēšanu, mazgāšanu un citām īpašībām.
Runājot par struktūru, virsmaktīvajām vielām ir kopīga iezīme, jo tajās molekulās ir divas dažādu rakstura grupas. Vienā galā ir gara nepolārā grupas ķēde, šķīstot eļļā un nešķīst ūdenī, kas pazīstama arī kā hidrofobiska grupa vai ūdens atgrūdoša grupa. Šāda ūdens atgrūdoša grupa parasti ir garas ogļūdeņražu ķēdes, dažreiz arī organiskā fluora, silīcija, organofosfāta, organotīna ķēdes utt. Hidrofilajai grupai jābūt pietiekami hidrofīlai, lai nodrošinātu, ka visas virsmaktīvās vielas šķīst ūdenī un tai ir nepieciešama šķīdība. Tā kā virsmaktīvās vielas satur hidrofīlas un hidrofobiskas grupas, tās var šķīst vismaz vienā no šķidruma fāzēm. Šo virsmaktīvās vielas hidrofilo un lipofīlo īpašību sauc par amfifilitāti.


Virsmaktīvā viela ir sava veida amfifilas molekulas gan ar hidrofobām, gan hidrofilām grupām. Virsmaktīvo vielu hidrofobās grupas parasti sastāv no garas ķēdes ogļūdeņražiem, piemēram, taisnas ķēdes alkilc8 ~ C20, sazarotās ķēdes alkil C8 ~ C20 , alkilfenilgrupa (alkilogļa toma skaits ir 8 ~ 16) un tamlīdzīgi. Atšķirība, kas ir neliela starp hidrofobām grupām, galvenokārt ir ogļūdeņražu ķēžu strukturālās izmaiņas. Un hidrofilu grupu veidi ir vairāk, tāpēc virsmaktīvo vielu īpašības galvenokārt ir saistītas ar hidrofilām grupām papildus hidrofobisko grupu lielumam un formai. Hidrofilo grupu strukturālās izmaiņas ir lielākas nekā hidrofobu grupām, tāpēc virsmaktīvo vielu klasifikācija parasti balstās uz hidrofilu grupu struktūru. Šīs klasifikācijas pamatā ir tas, vai hidrofilā grupa ir jonu vai nē, un tā ir sadalīta anjonu, katjonu, nejonu, cwitterionic un citos īpašos virsmaktīvās vielas veidos.

① Virsmaktīvo vielu adsorbcija interfacā
Virsmaktīvās vielas molekulas ir amfifiliskās molekulas, kurām ir gan lipofīlas, gan hidrofīlas grupas. Kad virsmaktīvo vielu izšķīdina ūdenī, tās hidrofilo grupu piesaista ūdens un izšķīst ūdenī, savukārt tās lipofīlo grupu atgrūst ar ūdeni un atstāj ūdeni, kā rezultātā virsmaktīvās vielas molekulas (vai jonus) adsorbē divu fāžu interfeisā, kas samazina saskarni starp divām fāzēm. Vairākas virsmaktīvās vielas molekulas (vai jonus) tiek adsorbētas saskarnē, jo lielāka ir saskarnes spriedzes samazināšanās.
② Dažas adsorbcijas membrānas īpašības
Adsorbcijas membrānas virsmas spiediens: virsmaktīvās vielas adsorbcija pie gāzes un šķidruma saskarnes, veidojot adsorbcijas membrānu, piemēram, uz saskarnes novietojiet bez berzes noņemamu peldošu loksni, peldošā loksne nospiež adsorbentu membrānu gar šķīduma virsmu, un membrāna rada spiedienu uz peldošo lapu, ko sauc par virsmas spiedienu.
Virsmas viskozitāte: tāpat kā virsmas spiediens, virsmas viskozitāte ir īpašība, ko uzrāda nešķīstoša molekulārā membrāna. Suspendēts ar smalka metāla stieples platīna gredzenu tā, ka tā plakne saskaras ar tvertnes ūdens virsmu, pagriež platīna gredzenu, platīna gredzenu ar ūdens traucējuma viskozitāti, amplitūda pakāpeniski samazinās, saskaņā ar kuru var izmērīt virsmas viskozitāti. Metode ir šāda: Pirmkārt, eksperimentu veic uz tīras ūdens virsmas, lai izmērītu amplitūdas sabrukšanu, un pēc tam mēra samazinājumu pēc virsmas membrānas veidošanās, un virsmas membrānas viskozitāte tiek iegūta no starpības starp abiem.
Virsmas viskozitāte ir cieši saistīta ar virsmas membrānas stabilitāti, un, tā kā adsorbcijas membrānai ir virsmas spiediens un viskozitāte, tai jābūt elastībai. Jo augstāks virsmas spiediens un jo augstāka ir adsorbētās membrānas viskozitāte, jo augstāks ir tās elastības modulis. Virsmas adsorbcijas membrānas elastīgais modulis ir svarīgs burbuļu stabilizācijas procesā.
③ Micellu veidošanās
Atšķaidīti virsmaktīvo vielu risinājumi ievēro likumus, kam seko ideāli risinājumi. Virsmaktīvās vielas daudzums, kas adsorbēts uz šķīduma virsmas, palielinās līdz ar šķīduma koncentrāciju, un, kad koncentrācija sasniedz vai pārsniedz noteiktu vērtību, adsorbcijas daudzums vairs nepalielinās, un šīs pārmērīgās virsmaktīvās vielas molekulas ir šķīdumā nejaušā veidā vai kaut kādā regulārā veidā. Gan prakse, gan teorija parāda, ka tās veido asociācijas risinājumos, un šīs asociācijas sauc par micelām.
Kritiskā micellu koncentrācija (CMC): minimālā koncentrācija, kurā virsmaktīvās vielas veido micellas šķīdumā, sauc par kritisko micellas koncentrāciju.
④ CMC parasto virsmaktīvo vielu vērtības.

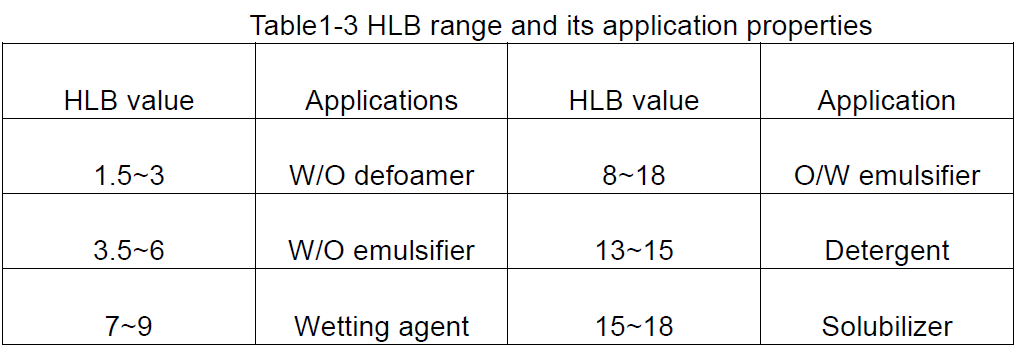
HLB ir hidrofila lipofilu līdzsvara saīsinājums, kas norāda uz virsmaktīvās vielas hidrofilās un lipofīlo grupu hidrofīlo un lipofīlo līdzsvaru virsmaktīvās vielas HLB vērtībā. Liela HLB vērtība norāda molekulu ar spēcīgu hidrofilitāti un vāju lipofilitāti; Un otrādi, spēcīga lipofilitāte un vāja hidrofilitāte.
① HLB vērtības noteikumi
HLB vērtība ir relatīva vērtība, tāpēc, kad tiek izstrādāta HLB vērtība, kā standarts, parafīna vaska HLB vērtība, kurai nav hidrofilu īpašību, ir norādīta kā 0, savukārt nātrija dodecila sulfāta HLB vērtība, kas ir vairāk ūdens šķīstoša. ir lipofīli, savukārt tie, kas lielāki par 10, ir hidrofīli. Tādējādi pagrieziena punkts no lipofīliem līdz hidrofīlam ir aptuveni 10.
Balstoties uz virsmaktīvo vielu HLB vērtībām, var iegūt vispārīgu ideju par to iespējamo lietojumu, kā parādīts 1.-3. Tabulā.

Divi savstarpēji nešķīstoši šķidrumi, viens izkliedēts otrā kā daļiņas (pilieni vai šķidrie kristāli) veido sistēmu, ko sauc par emulsiju. Šī sistēma ir termodinamiski nestabila, pateicoties abu šķidrumu robežas palielināšanai, kad veidojas emulsija. Lai emulsija būtu stabila, ir jāpievieno trešais komponents - emulgators, lai samazinātu sistēmas saskarnes enerģiju. Emulgators pieder virsmaktīvajai vielai, tā galvenā funkcija ir spēlēt emulsijas lomu. Emulsijas fāzi, kas pastāv kā pilienus, sauc par izkliedēto fāzi (vai iekšējo fāzi, pārtrauktu fāzi), un otra fāzi, kas ir saistīta kopā, sauc par izkliedes barotni (vai ārējo fāzi, nepārtrauktu fāzi).
① emulgatori un emulsijas
Parastās emulsijas, viena fāze ir ūdens vai ūdens šķīdums, otra fāze ir organiskas vielas, kas nav sajauktas ar ūdeni, piemēram, tauki, vasks utt. Eļļu, ko veido ūdens un eļļu, var iedalīt divos veidos atbilstoši to izkliedēšanas situācijai: eļļa, kas izkliedēta ūdenī, lai veidotu eļļu, lai veidotu emulsiju. (Ūdens/eļļa). Var veidot arī sarežģītu ūdeni eļļā ūdenī W/O/W tipa un eļļas-ūdens-eļļā O/W/O tipa vairāku emulsijas.
Emulgatori tiek izmantoti, lai stabilizētu emulsijas, samazinot saskarnes spriegojumu un veidojot vienas molekulas saskarnes membrānu.
Emulgatora prasību emulģēšanai:
A: Emulgatoram jāspēj adsorbēt vai bagātināt saskarni starp abām fāzēm, lai samazinātu saskarnes spriegojumu;
B: Emulgatoram ir jāpiešķir daļiņām lādiņam, lai elektrostatiskā atgrūšana starp daļiņām vai veidotu stabilu, ļoti viskozu aizsargājošu membrānu ap daļiņām.
Tāpēc vielai, ko izmanto kā emulgatoru, jābūt amfifiliskām grupām, lai emulģētu, un virsmaktīvās vielas var izpildīt šo prasību.
② Emulsiju un faktoru sagatavošanas metodes, kas ietekmē emulsiju stabilitāti
Emulsiju sagatavošanai ir divi veidi: viens ir izmantot mehānisko metodi, lai šķidrumu izkliedētu sīkās daļiņās citā šķidrumā, ko galvenokārt izmanto rūpniecībā, lai sagatavotu emulsijas; Otrs ir šķidruma izšķīdināšana molekulārā stāvoklī citā šķidrumā un pēc tam to pareizi savākt, veidojot emulsijas.
Emulsijas stabilitāte ir spēja veikt anti-daļiņu agregāciju, kas izraisa fāzu atdalīšanu. Emulsijas ir termodinamiski nestabilas sistēmas ar lielu brīvu enerģiju. Tāpēc tā sauktā emulsijas stabilitāte faktiski ir laiks, kas nepieciešams, lai sistēma sasniegtu līdzsvaru, ti, laiku, kas vajadzīgs, lai atdalītu vienu no sistēmas šķidrumiem.
Kad saskarnes membrāna ar taukainiem spirtiem, taukskābēm un taukainiem amīniem un citām polārajām organiskajām molekulām membrānas stiprība ir ievērojami augstāka. Tas notiek tāpēc, ka emulgatora molekulu un spirtu, skābju un amīnu un citu polāro molekulu saskarnes adsorbcijas slānī, lai veidotu "sarežģītu", lai palielinātu interfeisa membrānas stiprību.
Emulgatorus, kas sastāv no vairāk nekā divām virsmaktīvajām vielām, sauc par jauktiem emulgatoriem. Jaukts emulgators, kas adsorbēts ūdens/eļļas saskarnē; Starpmolekulārā darbība var veidot kompleksus. Sakarā ar spēcīgo starpmolekulāro darbību ir ievērojami samazināts saskarnes spriedze, ievērojami palielinās saskarnes adsorbētā emulgatora daudzums, palielinās saskarnes membrānas blīvuma veidošanās, stiprums palielinās.
Šķidro lodīšu lādiņam ir būtiska ietekme uz emulsijas stabilitāti. Stabilas emulsijas, kuru šķidrās lodītes parasti tiek uzlādētas. Ja tiek izmantots jonu emulgators, saskarnē adsorbētajam emulgatora jonam ir lipofīlā grupa, kas ievietota eļļas fāzē, un hidrofilā grupa atrodas ūdens fāzē, tādējādi liekot uzlādēt šķidrās lodītes. Kā emulsijas lodītes ar vienādu lādiņu, tās atgrūž viena otru, nav viegli aglomerējamas, lai palielinātu stabilitāti. Var redzēt, ka jo vairāk emulgatoru jonu adsorbēti uz lodītēm, jo lielāks lādiņš, jo lielāka ir spēja novērst krelles no aglomerācijas, jo stabilāka ir emulsijas sistēma.
Emulsijas izkliedes vides viskozitāte zināmā mērā ietekmē emulsijas stabilitāti. Parasti, jo augstāka ir izkliedes vides viskozitāte, jo augstāka ir emulsijas stabilitāte. Tas notiek tāpēc, ka izkliedes vides viskozitāte ir liela, kas spēcīgi ietekmē šķidrās lodīšu Brauna kustību un palēnina sadursmi starp šķidrajām lodītēm, lai sistēma būtu stabila. Parasti polimēru vielas, kuras var izšķīdināt emulsijās, var palielināt sistēmas viskozitāti un padarīt emulsiju stabilitāti augstāku. Turklāt polimēri var arī veidot spēcīgu interfeisu membrānu, padarot emulsijas sistēmu stabilāku.
Dažos gadījumos cietā pulvera pievienošana var arī padarīt emulsiju ir tendence stabilizēties. Cietais pulveris atrodas ūdenī, eļļā vai saskarnē, atkarībā no eļļas, ūdenī cietā pulvera mitrināšanas spēja, ja cietais pulveris nav pilnībā mitrs ar ūdeni, bet arī mitrs ar eļļu, paliks uz ūdens un eļļas saskarnes.
Cietais pulveris nepadara emulsiju stabilu, jo saskarnē savākts pulveris uzlabo interfeisa membrānu, kas ir līdzīga emulgatora molekulu saskarnes adsorbcijai, tāpēc, jo ciešāk cietā pulvera materiāls ir sakārtots interfeisā, jo stabilāks ir emulsija.
Virsmaktīvajām vielām ir spēja ievērojami palielināt nešķīstošu vai nedaudz ūdenī šķīstošu organisko vielu šķīdību pēc micellu veidošanas ūdens šķīdumā, un šķīdums šajā laikā ir caurspīdīgs. Šo micellas efektu sauc par šķīdināšanu. Virsmaktīvo vielu, kas var radīt šķīdināšanu, sauc par šķīdinātāju, un organiskās vielas, kas tiek izšķīdinātas, sauc par šķīdināto vielu.

Putām ir svarīga loma mazgāšanas procesā. Putas ir izkliedes sistēma, kurā gāze tiek izkliedēta šķidrumā vai cietā krāsā, ar gāzi kā izkliedētu fāzi un šķidrumu vai cietu kā izkliedējošo barotni, iepriekšējo, ko sauc par šķidrām putām, bet pēdējo saucas par cietām putām, piemēram, putu plastmasu, putu stiklu, putekļu cementu utt.
(1) putu veidošanās
Ar putām mēs šeit domājam gaisa burbuļu kopumu, kas atdalīts ar šķidru membrānu. Šāda veida burbulis vienmēr ātri palielinās līdz šķidruma virsmai, pateicoties lielajām blīvuma atšķirībām starp izkliedēto fāzi (gāzi) un izkliedes barotni (šķidrumu), apvienojumā ar šķidruma zemo viskozitāti.
Burbuļa veidošanas process ir ienest šķidrumā lielu daudzumu gāzes, un šķidruma burbuļi ātri atgriežas virsmā, veidojot burbuļu apkopojumu, kas atdalīts ar nelielu šķidruma gāzes daudzumu.
Putēm ir divas nozīmīgas īpašības morfoloģijas ziņā: viena ir tā, ka burbuļi kā izkliedēta fāze bieži ir polihedrālas formas, tas notiek tāpēc, ka burbuļu krustojumā ir tendence, ka šķidruma plēve ir plāna, lai burbuļi kļūtu daudzfedrālie, kad šķidruma plēve samazinās līdz noteiktā apjomā, tas izraisīja burbuļa plīstēšanu; Otrais ir tas, ka tīrie šķidrumi nevar veidot stabilas putas, šķidrums, kas var veidot putas, ir vismaz divas vai vairākas sastāvdaļas. Virsmaktīvo vielu ūdens šķīdumi ir raksturīgi sistēmām, kurām ir tendence uz putu ģenerēšanu, un to spēja ģenerēt putas ir saistīta arī ar citām īpašībām.
Virsmaktīvās vielas ar labu putojošu spēku sauc par putojošām aģentiem. Lai arī putojošajam aģentam ir laba putu spēja, bet izveidotās putas, iespējams, nespēj uzturēt ilgu laiku, tas ir, tā stabilitāte nebūt nav laba. Lai saglabātu putu stabilitāti, bieži putojošajā līdzeklī, lai pievienotu vielas, kas var palielināt putu stabilitāti, vielu sauc par putu stabilizatoru, parasti izmantots stabilizators ir laurilietanolamīns un dodecildimetilamīna oksīds.
(2) putu stabilitāte
Putas ir termodinamiski nestabila sistēma, un galīgā tendence ir tāda, ka šķidruma kopējais virsmas laukums sistēmā samazinās pēc burbuļa salaušanas un brīvā enerģija samazinās. Defējēšanas process ir process, kurā šķidruma membrāna, kas atdala gāzi, kļūst biezāka un plānāka, līdz tā sabojājas. Tāpēc putu stabilitātes pakāpi galvenokārt nosaka šķidruma izdalīšanās ātrums un šķidrās plēves stiprums. To ietekmē arī šādi faktori.
(3) putu iznīcināšana
Putu iznīcināšanas pamatprincips ir mainīt apstākļus, kas rada putas, vai arī novērst putu stabilizējošos faktorus, tādējādi ir gan fizikālās, gan ķīmiskās metodes, kas saistītas ar noteikšanu.
Fiziskā defolēšana nozīmē mainīt putu ražošanas apstākļus, vienlaikus saglabājot putu šķīduma ķīmisko sastāvu, piemēram, ārēji traucējumi, temperatūras vai spiediena izmaiņas un ultraskaņas apstrāde ir visas efektīvās fizikālās metodes, lai novērstu putas.
Ķīmiskā defolēšanas metode ir pievienot noteiktas vielas, lai mijiedarbotos ar putojošo līdzekli, lai samazinātu šķidrās plēves stiprību putās un tādējādi samazinātu putas stabilitāti, lai sasniegtu defētes mērķi, šādas vielas sauc par defoameriem. Lielākā daļa defoameru ir virsmaktīvās vielas. Tāpēc saskaņā ar defolēšanos mehānismu defoameram vajadzētu būt spēcīgai spējai samazināt virsmas spraigumu, viegli adsorbējamu uz virsmas, un mijiedarbība starp virsmas adsorbcijas molekulām ir vāja, adsorbcijas molekulas, kas izkārtotas atslābinātā struktūrā.
Ir dažādi defoameru veidi, bet būtībā tie visi ir nejonu virsmaktīvās vielas. Nejonu virsmaktīvajām vielām ir vērstas īpašības pie mākoņa punkta vai virs tā, un tās bieži tiek izmantotas kā defoameriem. Alkoholus, īpaši spirtu ar sazarojuma struktūru, taukskābēm un taukskābju esteriem, poliamīdiem, fosfātu esteriem, silikona eļļām utt., Parasti izmanto arī kā izcilus defoamerus.
(4) putas un mazgāšana
Starp putām un mazgāšanas efektivitāti nav tiešas saiknes, un putas nenorāda uz mazgāšanas efektivitāti. Piemēram, nejonu virsmaktīvajām vielām ir daudz mazāk putojošo īpašību nekā ziepēm, bet to dekontaminācija ir daudz labāka nekā ziepes.
Dažos gadījumos putas var būt noderīgas netīrumu un netīrumu noņemšanā. Piemēram, mazgājot traukus mājās, mazgāšanas līdzekļa putas paceļ eļļas pilienus un, berzējot paklājus, putas palīdz uzņemt putekļus, pulveri un citus cietus netīrumus. Turklāt putas dažreiz var izmantot kā mazgāšanas līdzekļa efektivitātes norādi. Tā kā tauku eļļām ir kavējoša ietekme uz mazgāšanas līdzekļa putām, kad ir pārāk daudz eļļas un pārāk maz mazgāšanas līdzekļa, putas netiks ģenerētas vai sākotnējās putas pazūd. Putas dažreiz var izmantot arī kā skalošanas tīrības rādītājs, jo putas daudzumam skalošanas šķīdumā ir tendence samazināties, samazinot mazgāšanas līdzekli, tāpēc putas daudzumu var izmantot, lai novērtētu skalošanas pakāpi.
Plašā nozīmē mazgāšana ir nevēlamu komponentu noņemšanas process no mazgājamā objekta un kāda mērķa sasniegšanas. Mazgāšana parastajā nozīmē attiecas uz netīrumu noņemšanas procesu no nesēja virsmas. Mazgājot, mijiedarbību starp netīrumiem un nesēju novājina vai novērš dažu ķīmisku vielu darbība (piemēram, mazgāšanas līdzeklis utt.), Lai netīrumu un nesēja kombinācija tiktu mainīta netīrumu un mazgāšanas līdzekļa kombinācijā, un, visbeidzot, netīrumi tiek atdalīti no nesēja. Tā kā mazgājamie objekti un noņemšanas netīrumi ir dažādi, mazgāšana ir ļoti sarežģīts process, un mazgāšanas pamatprocesu var izteikt šādās vienkāršās attiecībās.
Carrie ·· netīrumi + mazgāšanas līdzeklis = nesējs + netīrumi · mazgāšanas līdzeklis
Mazgāšanas procesu parasti var iedalīt divos posmos: pirmkārt, mazgāšanas līdzekļa darbībā netīrumi tiek atdalīti no tā nesēja; Otrkārt, atdalītie netīrumi tiek izkliedēti un apturēti vidē. Mazgāšanas process ir atgriezenisks process, un netīrumus, kas izkliedēti un apturēti barotnē, var arī pārzināt no barotnes uz mazgājamo objektu. Tāpēc labam mazgāšanas līdzeklim vajadzētu būt iespējai izkliedēt un apturēt netīrumus un novērst netīrumu pārcelšanos, papildus spējai noņemt netīrumus no nesēja.
(1) netīrumu veidi
Pat tajā pašā priekšmetā netīrumu veids, sastāvs un daudzums var mainīties atkarībā no vides, kādā tas tiek izmantots. Eļļas ķermeņa netīrumi galvenokārt ir dažas dzīvnieku un augu eļļas un minerāleļļas (piemēram, jēlnaftas, mazuta eļļa, ogļu darva utt.), Cietie netīrumi galvenokārt ir kvēpi, pelni, rūsa, oglekļa melns utt. Apģērba netīrumu ziņā ir netīrumi no cilvēka ķermeņa, piemēram, sviedri, sebum, asinis utt.; Netīrumi no pārtikas, piemēram, augļu traipiem, cepamo eļļas traipiem, garšvielu traipiem, cieti utt.; netīrumi no kosmētikas, piemēram, lūpu krāsu, nagu laku utt.; netīrumi no atmosfēras, piemēram, kvēpi, putekļi, dubļi utt.; Citi, piemēram, tinte, tēja, pārklājums utt. Tas ir dažādos veidos.
Dažādus netīrumu veidus parasti var iedalīt trīs galvenajās kategorijās: cietie netīrumi, šķidrie netīrumi un īpašie netīrumi.
① Cietie netīrumi
Parastie cietie netīrumi ietver pelnu, dubļu, zemes, rūsas un oglekļa melnu daļiņas. Lielākajai daļai šo daļiņu uz virsmas ir elektriskais lādiņš, vairums no tām ir negatīvi lādētas un tās var viegli adsorbēt uz šķiedras priekšmetiem. Cietie netīrumi parasti ir grūti izšķīdināt ūdenī, bet tos var izkliedēt un suspendēt ar mazgāšanas līdzekļu šķīdumiem. Cietie netīrumi ar mazāku masas punktu ir grūtāk noņemt.
② šķidruma netīrumi
Šķidrie netīrumi galvenokārt ir šķīstoši eļļā, ieskaitot augu un dzīvnieku eļļas, taukskābes, taukainus spirtu, minerāleļļas un to oksīdus. Starp tām var notikt augu un dzīvnieku eļļas, taukskābes un sārmu pārzauģēšana, savukārt taukainie spirti, minerāleļļas nesonificē sārmu, bet tos var šķīst spirtu, eteros un ogļūdeņražu organiskajos šķīdinātājos un notekcējošā ūdens šķīduma emulsifikācijā un izkliedēšanā. Eļļveida šķidruma netīrumiem parasti ir spēcīgs spēks ar šķiedrvielām, un tas ir stingrāk adsorbēts uz šķiedrām.
③ Īpašie netīrumi
Īpašie netīrumi ietver olbaltumvielas, cieti, asinis, cilvēku sekrēcijas, piemēram, sviedru, sebumu, urīnu un augļu sulu un tējas sulu. Lielākā daļa šāda veida netīrumus var ķīmiski un spēcīgi adsorbēt uz šķiedras priekšmetiem. Tāpēc to ir grūti mazgāt.
Dažādie netīrumu veidi reti sastopami atsevišķi, bet bieži tiek sajaukti kopā un adsorbēti uz objekta. Netīrumus dažreiz var oksidēt, sadalīties vai samazināties ārējās ietekmēs, tādējādi radot jaunus netīrumus.
(2) netīrumu adhēzija
Drēbes, rokas utt. Var iekrāsot, jo starp objektu un netīrumiem ir kaut kāda veida mijiedarbība. Netīrumi tiek ievēroti objektiem dažādos veidos, bet nav tikai fiziskas un ķīmiskas saaugumi.
① Kauņu, putekļu, dubļu, smilšu un kokogļu saķere ar apģērbu ir fiziska saķere. Vispārīgi runājot, izmantojot šo netīrumu saķeri, un loma starp iekrāsoto objektu ir salīdzinoši vāja, arī netīrumu noņemšana ir samērā vienkārša. Saskaņā ar dažādiem spēkiem netīrumu fizisko saķeri var iedalīt mehāniskā adhēzijā un elektrostatiskajā saķerēšanā.
A: Mehāniskā saķere
Šāda veida saķere galvenokārt attiecas uz dažu cietu netīrumu (piemēram, putekļu, dubļu un smiltis) saķeri. Mehāniskā saķere ir viena no vājākajām netīrumu saķeres formām, un to var noņemt gandrīz ar tīri mehāniskiem līdzekļiem, bet, kad netīrumi ir mazi (<0,1um), to ir grūtāk noņemt.
B : Elektrostatiskā saķere
Elektrostatiskā adhēzija galvenokārt izpaužas uzlādētu netīrumu daļiņu darbībā uz pretēji uzlādētiem objektiem. Lielākā daļa šķiedru priekšmetu ir negatīvi lādēti ūdenī, un tos var viegli ievērot ar noteiktiem pozitīvi uzlādētiem netīrumiem, piemēram, kaļķu tipiem. Daži netīrumi, kaut arī negatīvi uzlādēti, piemēram, oglekļa melnās daļiņas ūdens šķīdumos, var pielipt šķiedrām caur jonu tiltiem (joniem starp vairākiem pretēji uzlādētiem priekšmetiem, kas kopā ar tiem darbojas tiltam līdzīgā veidā), ko veido pozitīvi joni ūdenī (piemēram, Ca2+ , Mg2+ utt.).
Elektrostatiskā darbība ir spēcīgāka nekā vienkārša mehāniska darbība, padarot netīrumu noņemšanu samērā grūtu.
② Ķīmiskā adhēzija
Ķīmiskā adhēzija attiecas uz netīrumu fenomenu, kas darbojas uz objekta caur ķīmiskām vai ūdeņraža saitēm. Piemēram, polārie cietie netīrumi, olbaltumvielas, rūsa un cita šķiedru priekšmetu saķere ar šķiedrām ir karboksilgrupa, hidroksilgrupa, amīds un citas grupas, šīs grupas un taukainas netīrās taukskābes, taukainus spirtu ir viegli veidot ūdeņraža saites. Ķīmiskie spēki parasti ir spēcīgi, un tāpēc netīrumi ir stingrāk saistīti ar objektu. Šāda veida netīrumus ir grūti noņemt, izmantojot parastās metodes, un, lai to risinātu, ir vajadzīgas īpašas metodes.
Netīrumu saķera pakāpe ir saistīta ar paša netīrumu raksturu un objekta raksturu, kuram tas tiek ievērots. Parasti daļiņas viegli pielīp pie šķiedrainiem priekšmetiem. Jo mazāka ir cietā netīrumu tekstūra, jo spēcīgāka ir saķere. Polārie netīrumi uz hidrofīliem priekšmetiem, piemēram, kokvilna un stikls, pieliek daudz spēcīgāk nekā nepolārais netīrums. Nepolārie netīrumi pielīp daudz spēcīgāk nekā polārie netīrumi, piemēram, polārie tauki, putekļi un māls, un to ir mazāk viegli noņemt un notīrīt.
(3) netīrumu noņemšanas mehānisms
Mazgāšanas mērķis ir noņemt netīrumus. Noteiktas temperatūras (galvenokārt ūdens) barotnē. Izmantojot mazgāšanas līdzekļa dažādo fizisko un ķīmisko iedarbību, lai vājinātu vai novērstu netīrumu un mazgātu priekšmetu iedarbību, iedarbojoties ar noteiktu mehānisko spēku (piemēram, ar rokām berzēšanu, veļas mazgājamo mašīnu uzbudinājumu, ūdens triecienu), lai netīrumi un mazgāti objekti no dekontaminācijas mērķa.
① šķidruma netīrumu noņemšanas mehānisms
A : Mitrināšana
Šķidruma netīrība galvenokārt ir uz eļļas bāzes. Eļļas traipi ir mitrāki šķiedru priekšmeti un vairāk vai mazāk izplatās kā eļļas plēve uz šķiedru materiāla virsmas. Pirmais mazgāšanas darbības solis ir virsmas mitrināšana ar mazgāšanas šķidrumu. Ilustrācijas labad šķiedras virsmu var uzskatīt par gludu cietu virsmu.
B: naftas atdalīšana - kērlinga mehānisms
Otrais mazgāšanas darbības solis ir eļļas un tauku noņemšana, šķidruma netīrumu noņemšana tiek panākta ar sava veida spirāli. Šķidruma netīrumi sākotnēji pastāvēja uz virsmas izkliedētas eļļas plēves formā un zem mazgāšanas šķidruma preferenciālās mitrināšanas iedarbības uz cietās virsmas (ti, šķiedrvielu virsmu), tas soli pa solim saliecās eļļas lodītēs, kuras aizstāja ar mazgāšanas šķidrumu un galu galā atstāja virsmu noteiktos ārējos spēkos.
② Cietu netīrumu noņemšanas mehānisms
Šķidruma netīrumu noņemšana galvenokārt notiek ar netīrumu nesēja preferenciālu mitrināšanu ar mazgāšanas šķīdumu, savukārt cieto netīrumu noņemšanas mehānisms ir atšķirīgs, kur mazgāšanas process galvenokārt ir saistīts ar netīrumu masas mitrināšanu un tās nesēj virsmas ar mazgāšanas šķīdumu. Sakarā ar virsmaktīvo vielu adsorbciju uz cietajiem netīrumiem un tā nesēja virsmu, tiek samazināta mijiedarbība starp netīrumiem un virsmu un tiek samazināta netīrumu masas saķeres izturība uz virsmas, tādējādi netīrumu masu viegli noņemt no nesēja virsmas.
Turklāt virsmaktīvo vielu, īpaši jonu virsmaktīvo vielu adsorbcija uz cietā netīrumu un tā nesēja virsmas, ir potenciāls palielināt cietā netīrumu virsmas un tā nesēja virsmas, kas vairāk veicina netīrumu noņemšanu. Cietas vai parasti šķiedru virsmas parasti tiek negatīvi uzlādētas ūdens vidē, un tāpēc tās var veidot difūzus dubultos elektroniskos slāņus uz netīrumu masas vai cietām virsmām. Sakarā ar viendabīgu lādiņu atgrūšanu netīrumu daļiņu saķere ūdenī līdz cietajai virsmai ir novājināta. Kad tiek pievienota anjonu virsmaktīvā viela, jo tā vienlaikus var palielināt netīrumu daļiņu un cietās virsmas negatīvo virsmas potenciālu, atgrūšana starp tām ir vairāk pastiprināta, daļiņas saķeres stiprums ir vairāk samazināts, un netīrumus ir vieglāk noņemt.
Nejonu virsmaktīvās vielas tiek adsorbētas uz parasti uzlādētām cietām virsmām, un, lai arī tās būtiski nemaina saskarnes potenciālu, adsorbētās nejonu virsmaktīvās vielas mēdz veidot noteiktu adsorbēta slāņa biezumu uz virsmas, kas palīdz novērst netīrumu atkārtotu noteikšanu.
Katjonu virsmaktīvo vielu gadījumā to adsorbcija samazina vai novērš netīrumu masas un tās nesēja virsmas negatīvo virsmas potenciālu, kas samazina atgrūšanu starp netīrumiem un virsmu un tāpēc tā neveicina netīrumu noņemšanu; Turklāt pēc adsorbcijas uz cietās virsmas katjonu virsmaktīvās vielas mēdz pagriezt cietās virsmas hidrofobiskas un tāpēc tās neveicina virsmas mitrināšanu un tāpēc mazgāšanu.
③ Īpašo augsņu noņemšana
Olbaltumvielas, cieti, cilvēku sekrēciju, augļu sulu, tējas sulu un citus šādus netīrumus ir grūti noņemt ar normālām virsmaktīvajām vielām un nepieciešama īpaša attieksme.
Olbaltumvielu traipus, piemēram, krēmam, olām, asinīm, piena un ādas ekskrementiem, ir tendence coagulēt uz šķiedrām un deģenerāciju un iegūt spēcīgāku saķeri. Olbaltumvielu netīrumu var noņemt, izmantojot proteāzes. Fermenta proteāze sadala olbaltumvielas netīrumos ūdenī šķīstošajās aminoskābēs vai oligopeptīdos.
Cietes traipi galvenokārt nāk no pārtikas produktiem, citiem, piemēram, mērce, līme utt. Amilāzei ir katalītiska ietekme uz cietes traipu hidrolīzi, izraisot cietes sadalīšanos cukuros.
Lipāze katalizē triglicerīdu sadalīšanos, kurus ir grūti noņemt, izmantojot normālas metodes, piemēram, sebumu un ēdamās eļļas, un sadala tos šķīstošā glicerīnā un taukskābēs.
Dažus krāsainus traipus no augļu sulām, tējas sulām, tintēm, lūpu krāsu utt. Bieži vien ir grūti rūpīgi tīrīt pat pēc atkārtotas mazgāšanas. Šos traipus var noņemt ar redoksreakciju ar oksidējošu vai reducējošu līdzekli, piemēram, Bleach, kas iznīcina krāsu ģenerējošu vai krāsu-sakušanas grupu struktūru un sadala tos mazākos ūdenī šķīstošos komponentos.
(4) DRAUDZEKĻU SKAIDROŠINĀŠANAS MEKLĒŠANA
Iepriekš minētais faktiski ir paredzēts ūdenim kā mazgāšanas līdzeklim. Faktiski dažādu apģērba un struktūras veidu dēļ daži apģērbs, izmantojot ūdens mazgāšanu, nav ērti vai nav viegli mazgāt tīru, nedaudz apģērba pēc mazgāšanas un pat deformācijas, izbalēšana utt., Piemēram, vairums dabisko šķiedru absorbē ūdeni un viegli uzbriest, kā arī sausu un viegli sarukt, tāpēc pēc mazgāšanas būs deformētas; Mazgājot vilnas izstrādājumus, bieži parādās arī saraušanās parādība, dažus vilnas produktus ar ūdens mazgāšanu ir arī viegli pīling, krāsu maiņa; Daži zīda roku sajūta pēc mazgāšanas kļūst sliktāka un zaudē savu spīdumu. Šīs drēbes bieži izmanto sausas tīrīšanas metodi, lai dekontaminētu. Tā sauktā ķīmiskā tīrīšana parasti attiecas uz mazgāšanas metodi organiskos šķīdinātājos, īpaši nepolāros šķīdinātājos.
Sausā tīrīšana ir maigāks mazgāšanas veids nekā ūdens mazgāšana. Tā kā ķīmiskajai tīrīšanai nav nepieciešama liela mehāniska darbība, tā neizraisa bojājumus, grumbu un deformāciju apģērbam, savukārt ķīmiskās tīrīšanas līdzekļi, atšķirībā no ūdens, reti rada izplešanos un kontrakcijas. Kamēr tehnoloģija tiek pareizi apstrādāta, drēbes var ķīmiski notīrīt bez izkropļojumiem, krāsu izbalēšanas un pagarinātu kalpošanas laiku.
Ēriskās tīrīšanas ziņā ir trīs plaši netīrumu veidi.
①, šķīstoši šķīstoši netīrumi šķīstoši netīrumi ietver visa veida eļļu un taukus, kas ir šķidrs vai taukains un var izšķīdināt ķīmiskās tīrīšanas šķīdinātājos.
Ūdens šķīstoši netīrumi, Ūdens šķīstoši netīrumi šķīst ūdens šķīdumos, bet ne ķīmiskās tīrīšanas līdzekļos, tiek adsorbēti uz apģērba ūdens stāvoklī, ūdens iztvaiko pēc granulētu cietvielu, piemēram, neorganisko sāļu, cietes, olbaltumvielu utt., Izgulsnēšanas, utt.
③ Soils un ūdens nešķīst netīrumu eļļu un ūdeni nešķīstoši netīrumi nav ne ūdenī, ne šķīst sausā tīrīšanas šķīdinātājos, piemēram, oglekļa melnos, dažādu metālu un oksīdu silikātos utt.
Sakarā ar dažādu veidu netīrumu atšķirīgajiem rakstiem, sausās tīrīšanas procesā ir dažādi veidi, kā noņemt netīrumus. Eļļos šķīstošas augsnes, piemēram, dzīvnieku un augu eļļas, minerāleļļas un smērvielas, ir viegli šķīstoši organiskos šķīdinātājos, un to var vieglāk noņemt ķīmiskajā tīrīšanā. Sausa tīrīšanas šķīdinātāju lieliskā šķīdība eļļām un smērvielām būtībā nāk no van der sienu spēkiem starp molekulām.
Lai noņemtu ūdeni šķīstošus netīrumus, piemēram, neorganiskos sāļus, cukurus, olbaltumvielas un sviedrus, sausās tīrīšanas līdzeklim ir jāpievieno arī pareizais ūdens daudzums, pretējā gadījumā no apģērba ir grūti noņemt no ūdens šķīstošiem netīrumiem. Tomēr ūdeni ir grūti izšķīdināt sausā tīrīšanas līdzeklī, tāpēc, lai palielinātu ūdens daudzumu, jums arī jāpievieno virsmaktīvās vielas. Ūdens klātbūtne sausā tīrīšanas līdzeklī var padarīt netīrumu un apģērba virsmu hidratētu, lai to būtu viegli mijiedarboties ar virsmaktīvo vielu polārajām grupām, kas veicina virsmaktīvo vielu adsorbciju uz virsmas. Turklāt, kad virsmaktīvās vielas veido micellas, ūdenī šķīstošus netīrumus un ūdeni var izšķīdināt micellās. Papildus ūdens satura palielināšanai sausā tīrīšanas šķīdinātājā, virsmaktīvajām vielām var būt nozīme arī netīrumu atkārtotas novirzīšanas novēršanā, lai uzlabotu dekontaminācijas efektu.
Neliela ūdens daudzuma klātbūtne ir nepieciešama, lai noņemtu ūdeni šķīstošus netīrumus, bet pārāk daudz ūdens var izraisīt kropļojumus un saburzīties dažās drēbēs, tāpēc ūdens daudzumam sausās tīrīšanas līdzeklim jābūt mērenam.
Netīrumi, kas nav ne ūdenī šķīstoši, ne ar eļļu šķīstoši, cietas daļiņas, piemēram, pelni, dubļi, zemes un oglekļa melns, parasti ir piestiprināts pie apģērba ar elektrostatiskiem spēkiem vai kombinācijā ar eļļu. Sausās tīrīšanas laikā šķīdinātāja plūsma, trieciens var padarīt netīrumu elektrostatiskā spēka adsorbciju, un sausa tīrīšanas līdzeklis var izšķīdināt eļļu tā, ka eļļas un netīrumu kombinācija un piestiprināta pie cietu daļiņu apģērba sausā tīrīšanas līdzeklī, sausās tīrīšanas līdzeklim, kas atrodas zemē, lai to izturētu, lai tās būtu izturīgas, lai tās varētu izturēt, lai tās varētu izturēt, lai tās varētu izturēt, lai tās būtu izturīgas, lai tās varētu izturēt, lai tās varētu izturēt, lai tās būtu izturīgas, lai tās varētu izturēt, lai tās varētu izturēt, lai tās būtu izturīgas, lai tās varētu izturēt, lai tās varētu izturēt, lai tās varētu izturēt, lai tās varētu izturēt, lai tās būtu izturīgas, lai tās varētu izturēt, lai tās varētu izturēt, lai tās varētu izturēt, lai tās varētu izturēt, lai tās būtu izturīgas, lai tās varētu izturēt, lai tās varētu izturēt, lai tās varētu izturēt, lai tās būtu izturīgas, lai tās varētu izturēt, lai tās varētu izturēt, lai tās varētu izturēt, lai tās varētu izturēt, lai tās būtu stabili, kas atrodas uz stabilām daļām. apģērbs.
(5) Faktori, kas ietekmē mazgāšanas darbību
Virsmaktīvo vielu virziena adsorbcija saskarnē un virsmas (interfeisa) spriedzes samazināšana ir galvenie šķidruma vai cieta netīrumu noņemšanas faktori. Tomēr mazgāšanas procesu ir sarežģīts, un mazgāšanas efektu, pat ar tādu pašu mazgāšanas līdzekli, ietekmē daudzi citi faktori. Šie faktori ietver mazgāšanas līdzekļa koncentrāciju, temperatūru, netīrumu raksturu, šķiedras veidu un auduma struktūru.
① Virsmaktīvās vielas koncentrācija
Virsmaktīvo vielu micellām šķīdumā ir liela nozīme mazgāšanas procesā. Kad koncentrācija sasniedz kritisko micellu koncentrāciju (CMC), mazgāšanas efekts strauji palielinās. Tāpēc mazgāšanas līdzekļa koncentrācijai šķīdinātājā jābūt augstākai par CMC vērtību, lai būtu labs mazgāšanas efekts. Tomēr, ja virsmaktīvās vielas koncentrācija ir augstāka par CMC vērtību, pieaugošā mazgāšanas efekta pieaugums nav acīmredzams, un nav nepieciešams pārāk daudz palielināt virsmaktīvās vielas koncentrāciju.
Noņemot eļļu, izšķīdinot, palielinoties virsmaktīvo vielu koncentrācijai, šķīdināšanas efekts palielinās, pat ja koncentrācija pārsniedz CMC. Šajā laikā ieteicams izmantot mazgāšanas līdzekli vietējā centralizētā veidā. Piemēram, ja uz aprocēm un apģērba apkaklēm ir daudz netīrumu, mazgāšanas laikā var uzklāt mazgāšanas līdzekļa slāni, lai palielinātu virsmaktīvās vielas šķīdināto iedarbību uz eļļu.
②Temperature ir ļoti svarīga ietekme uz dekontaminācijas darbību. Parasti temperatūras paaugstināšanās atvieglo netīrumu noņemšanu, bet dažreiz pārāk augsta temperatūra var izraisīt arī trūkumus.
Temperatūras paaugstināšanās atvieglo netīrumu difūziju, cietā smērviela tiek viegli emulģēta temperatūrā virs tā kušanas temperatūras, un šķiedras palielinās temperatūras paaugstināšanās dēļ, kas visi atvieglo netīrumu noņemšanu. Tomēr kompaktajiem audumiem mikrogaps starp šķiedrām tiek samazināts, paplašinoties šķiedrām, kas kaitē netīrumu noņemšanai.
Temperatūras izmaiņas ietekmē arī virsmaktīvo vielu šķīdību, CMC vērtību un micellas lielumu, tādējādi ietekmējot mazgāšanas efektu. Virsmaktīvo vielu ar garām oglekļa ķēdēm šķīdība zemā temperatūrā ir zema, un dažreiz šķīdība ir pat zemāka par CMC vērtību, tāpēc mazgāšanas temperatūra ir atbilstoši paaugstināta. Temperatūras ietekme uz CMC vērtību un micellas lielumu jonu un jonu virsmaktīvajām vielām ir atšķirīga. Jonu virsmaktīvajām vielām temperatūras paaugstināšanās parasti palielina CMC vērtību un samazina micellas lielumu, kas nozīmē, ka vajadzētu palielināt virsmaktīvās vielas koncentrāciju mazgāšanas šķīdumā. Nejonu virsmaktīvajām vielām temperatūras paaugstināšanās izraisa CMC vērtības samazināšanos un ievērojamu micellu tilpuma palielināšanos, tāpēc ir skaidrs, ka atbilstošs temperatūras paaugstināšanās palīdzēs nejonu virsmaktīvajai vielai radīt tās virsmas aktīvo efektu. Tomēr temperatūrai nevajadzētu pārsniegt tā mākoņa punktu.
Īsāk sakot, optimālā mazgāšanas temperatūra ir atkarīga no mazgāšanas līdzekļa sastāva un mazgājamā objekta. Dažiem mazgāšanas līdzekļiem ir laba mazgāšanas līdzekļa iedarbība istabas temperatūrā, savukārt citiem ir daudz atšķirīga mazgāšanas līdzeklis starp aukstumu un karsto mazgāšanu.
③ putas
Parasti ir sajaukt putojošo spēku ar mazgāšanas efektu, uzskatot, ka mazgāšanas līdzekļiem ar augstu putojošu spēku ir labs mazgāšanas efekts. Pētījumi liecina, ka starp mazgāšanas efektu un putām nav tiešas saistības. Piemēram, mazgāšana ar zemiem putojošiem mazgāšanas līdzekļiem ir ne mazāk efektīva kā mazgāšana ar augstu putojošo mazgāšanas līdzekļiem.
Lai arī putas nav tieši saistītas ar mazgāšanu, ir gadījumi, kad tas palīdz noņemt netīrumus, piemēram, mazgājot traukus ar rokām. Berzējot paklājus, putas var atņemt arī putekļus un citas cietas netīrumu daļiņas, paklāju netīrumi veido lielu daļu putekļu, tāpēc paklāju tīrīšanas līdzekļiem vajadzētu būt noteiktām putojošām spējām.
Putojoša jauda ir svarīga arī šampūniem, kur smalkās putas, ko šķidrums ražo šampūnas laikā vai peldoties, atstāj matus, kas jūtas ieeļļoti un ērti.
④ Šķiedru šķirnes un tekstilizstrādājumu fiziskās īpašības
Papildus šķiedru ķīmiskajai struktūrai, kas ietekmē netīrumu saķeri un noņemšanu, šķiedru parādīšanās un dzijas un auduma organizācija ietekmē netīrumu noņemšanu.
Vilnas šķiedru svari un kokvilnas šķiedru izliektās plakanās lentes, visticamāk, uzkrāj netīrumus nekā gludas šķiedras. Piemēram, oglekļa melnu krāsā iekrāsotu celulozes plēvēs (viskozes plēves) ir viegli noņemt, savukārt kokvilnas audumos ir grūti mazgāt oglekļa melno krāsošanu. Vēl viens piemērs ir tas, ka no poliestera izgatavotiem īsās šķiedras audumiem ir vairāk tendence uzkrāt eļļas traipus nekā garu šķiedrvielu audumus, un arī eļļas traipus uz īsās šķiedras audumiem ir grūtāk noņemt nekā eļļas traipus uz ilgstošu šķiedrvielu audumiem.
Cieši savīti pavedieni un stingri audumi, ņemot vērā nelielo spraugu starp šķiedrām, var pretoties netīrumu iebrukumam, bet tas pats var arī novērst mazgāšanas šķidruma izslēgšanu, lai izslēgtu iekšējos netīrumus, tāpēc šaurie audumi sāk pretoties netīrumiem, bet savulaik iekrāsota mazgāšana ir grūtāka.
⑤ Ūdens cietība
Ca2+, Mg2+ un citu metāla jonu koncentrācijai ūdenī ir liela ietekme uz mazgāšanas efektu, it īpaši, ja anjonu virsmaktīvās vielas sastopas ar Ca2+ un Mg2+ joniem, kas veido kalciju un magnija sāļus, kas ir mazāk šķīstoši un samazinās tā mazgāšanu. Cietā ūdenī, pat ja virsmaktīvās vielas koncentrācija ir augsta, mazgāšanas līdzeklis joprojām ir daudz sliktāks nekā destilācijā. Lai virsmaktīvajai vielai būtu vislabākā mazgāšanas efekts, Ca2+ jonu koncentrācija ūdenī jāsamazina līdz 1 x 10-6 mol/L (Caco3 līdz 0,1 mg/L) vai mazāk. Tam ir nepieciešams pievienot dažādus mīkstinātājus mazgāšanas līdzeklim.
Pasta laiks: 20.-2022. Februāris



